Les références institutionnelles au regard de l’organisation du circuit du médicament à la prise en charge médicamenteuse ne cessent d’évoluer en vue d’une amélioration continue de la qualité et de la sécurité de la prise en charge médicamenteuse du patient en établissement de santé.
- Arrêté du 6 avril 2011 relatif au management de la qualité de la prise en charge médicamenteuse et aux médicaments dans les établissements de santé
- Décret n° 2010-1029 du 30 août 2010 relatif à la politique du médicament et des dispositifs médicaux stériles dans les établissements de santé
- Décret no 2010-1228 du 19 octobre 2010 relatif aux conditions dans lesquelles certains établissements de santé peuvent faire appel à des pharmacies d’officine ou à la pharmacie à usage intérieur d’un autre établissement
- Décret n° 2008-1121 du 31 octobre 2008 relatif au contrat de bon usage des médicaments et des produits et prestations mentionné à l’article L. 162-22-7 du code de la sécurité sociale .
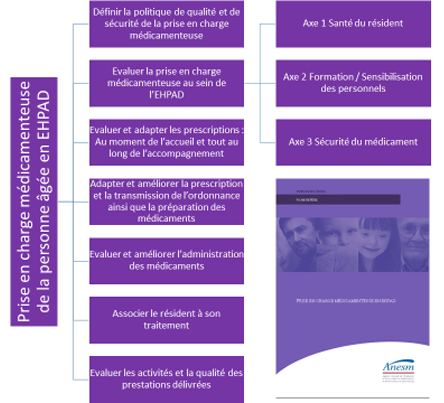
Les recommandations institutionnelles entre autres de la Haute Autorité de Santé, de l’ANAP, de l’ANSM, de la SFGG, des ARS, de l’OMEDIT, (…) et de l’ANESM représentent autant de références ayant contribué depuis ces dix dernières années au développement des compétences et des pratiques professionnelles visant la sécurité de la prise en charge médicamenteuse spécifique du sujet âgé au profil vulnérable et de lutter contre la Iatrogénie ayant un impact délétère.
En EHPAD, le système PDA « Préparation des Doses à Administrer » reste attendu pour parfaire la sécurisation du médicament au dépend de la pharmacie : Office ou Pharmacie à Usage Interne. Cette relation « Client – Fournisseur » est convenue par convention entre les parties à partir de laquelle le gérant des produits pharmaceutiques voit sa responsabilité engagée dans sa prestation lui imposant la sécurisation du circuit du médicament, des ressources en professionnels et en réseaux, une nouvelles organisation et des pratiques, des équipements et/ou de nouvelles technologies.
La Sérialisation des médicaments est lancée depuis le 9 février 2019
Conformément au Règlement 2016/61 de la Communauté européenne, les obligations relatives à la sérialisation sont entrées en vigueur le 9 février 2019.
Ce Règlement vient compléter l’art 54 bis de la Directive 2011/62/UE relatif à l’obligation de doter certains médicaments de dispositifs de sécurité et précise les médicaments concernés (annexe I et II) ainsi que le type de dispositif attendu : Un dispositif anti-effraction et un identifiant unique.
Il fait suite aux Notes d’informations réglementaires :
Note d’information n° DGOS/PF2/DGS/PP2/2019/20 du 31/01/2019 visant à rappeler les obligations prévues par le règlement délégué (UE) 2016/61 de la commission du 2 octobre 2015 relatives à la sérialisation, les mesures transitoires et la conduite à tenir pour finaliser la mise en œuvre.
Note d’information n° DGS/PP2/DGOS/PF2 du 8 février 2018 visant à rappeler aux pharmacies d’officine et aux établissements de santé leurs obligations prévues par le règlement délégué (UE) 2016/61 de la Commission du 2 Octobre 2015 en fixant les modalités des dispositifs de sécurité, dans le cadre de la prévention de l’introduction dans la chaine d’approvisionnement légale de médicaments falsifiés (sérialisation).
Note d’information n° DGOS/PF2/DGS/PP2/2018/196 du 2 août 2018 visant à informer les établissements de santé de la publication d’un guide méthodologique relatif au déploiement du dispositif sérialisation : Lutte contre la falsification des médicaments dans les Etablissements de Santé
La direction générale de la santé (DGS) et la Direction générale de l’offre de soins (DGOS) proposent un guide méthodologique pour accompagner le déploiement de la sérialisation du médicament précisant que « les opérations de vérification et désactivation se feront au sein des PUI par les personnels autorisés et habilités soit : à la réception, au stockage, lors de la PDA, etc. ».
L’organisme France MVO est chargé de l’interopérabilité informatique du système de vérification de chaque médicament avec les acteurs et propose :
- un site internet https://www.france-mvo.fr/
- une FAQ spécifique « acteurs de la sérialisation » : https://www.france-mvo.fr/faq-relatives-aux-acteurs-de-la-serialisation/
- une messagerie électronique: [email protected]
- deux fiches techniques spécifiques :
- Fiche Technique Officine
- Fiche Technique PUI – Hôpital
De la production jusqu’au patient, le nouveau dispositif nécessite des changements organisationnels : adaptation des lignes de production pour la mise en place de l’identifiant unique et du dispositif antieffraction et adaptation des systèmes informatiques de l’ensemble des professionnels du médicament. Cette amélioration de la chaîne de distribution du médicament en France renforcera la sécurité des médicaments dispensés aux patients.
L’ensemble des acteurs du circuit du médicament (industriels du médicament, grossistes-répartiteurs et dépositaires, importateurs parallèles, pharmaciens d’officine et hospitaliers) ainsi que le ministère des Solidarités et de la Santé, l’Agence nationale de sécurité du médicament (ANSM) et les agences régionales de santé (ARS), sont pleinement engagés dans la réussite de ce projet. Cette mobilisation sans précédent s’inscrit dans un mouvement international de sécurisation du circuit du médicament.